
黃精因其優(yōu)異的生物活性而被廣泛應用。本研究以黃精為原料制備了一種新的黃精多糖。通過單糖組成分析,PSP主要由果糖和葡萄糖組成,摩爾比為93.81:5.12。鑒定出主要的連鎖類型為α-D-Glcp1→和→2-β-D-Fruf-1→。模擬唾液和胃腸消化后,PSP分子量無明顯變化。然而,PSP可以被腸道細菌分解。我們的研究結(jié)果表明,PSP管理增加了益生菌如雙歧桿菌的豐度。此外,腸道微生物可以利用PSP產(chǎn)生短鏈脂肪酸,包括乙酸、丙酸和丁酸。PSP發(fā)酵液對DPPH、超氧自由基、羥基自由基等自由基均有較好的清除作用。綜上所述,本研究將有助于促進PSP作為益生元在功能食品和醫(yī)療行業(yè)的應用。
1. 介紹
益生元是一種不可消化的成分,通過腸道微生物的代謝調(diào)節(jié)腸道菌群的組成或活性,從而對宿主產(chǎn)生有益的生理作用。近年來,植物多糖的益生元潛力受到廣泛關(guān)注,主要包括菊粉、低聚果糖、阿拉伯木聚糖和各種膳食纖維。益生元可特異性促進腸道益生菌如乳桿菌、雙歧桿菌的生長。這些來自植物的益生元可以被結(jié)腸內(nèi)的腸道菌群發(fā)酵,細菌將多糖分解成低聚糖、短鏈脂肪(SCFAs)等產(chǎn)物,有助于宿主的健康。黃精屬百合科,作為一種具有藥用和食用雙重用途的植物,具有豐富的食物用途。而且,根莖在日常生活中,它也被用來制作草藥酒或煮成茶的替代品。在一些地區(qū),人們將黃精根莖作為添加劑添加到蛋糕或調(diào)味料中。此外,還能刺激唾液和胃液分泌,保護呼吸系統(tǒng),促進食欲,增強免疫力。木犀草主要由甾體皂苷、類黃酮[8]、生物堿[9]、木脂素、氨基酸、多糖等組成。尤其是主成分,即黃精(Polygonatum sibiricum polysaccharides, PSP),據(jù)報道具有降血糖、抗癌、抗氧化、抗炎和抗骨質(zhì)疏松等作用。
通常,多糖經(jīng)胃腸道消化后,其化學結(jié)構(gòu)、分子量和生物活性都會發(fā)生顯著變化。例如,胃腸道內(nèi)消化酶和pH值的變化可能會影響多糖攝入后的理化性質(zhì)。然而,對于那些具有益生元作用的多糖,它們在上消化道是無法消化的,如Gracilaria rubra polysaccharides (GRPS)和Lycium barbarum polysaccharides (LBPS)。到目前為止,宿主分泌的消化酶是否能分解腸道內(nèi)的PSP尚不清楚。……,PSP在胃腸道中的消化特性及其對宿主腸道菌群組成的影響仍有待進一步研究。
本研究旨在探討PSP在體外唾液-胃腸消化和隨后的人體糞便發(fā)酵過程中理化性質(zhì)的變化。采用水提醇沉法制備了PSP,并對其理化性質(zhì)進行了研究。接下來,我們研究了模擬唾液-胃腸消化過程中PSP的動態(tài)特性。通過體外發(fā)酵模型,探討PSP對人體腸道菌群發(fā)酵及其代謝物(SCFAs)產(chǎn)生的影響。并對PSP發(fā)酵產(chǎn)物的抗氧化活性進行了研究。
2、研究結(jié)果
1)PSP的物理化學性質(zhì)
我們分析了PSP的理化性質(zhì),結(jié)果表明,PSP的總碳水化合物含量豐富,還原糖、蛋白質(zhì)和醛酸含量低。PSP的色譜圖顯示為一個對稱的單峰,從分子量分布來看,它是均勻的。HPGPC法測定PSP分子量為3.06 kDa。由于PMP衍生化法對果糖結(jié)構(gòu)造成破壞,因此在PSP的HPLC色譜圖中沒有出現(xiàn)果糖峰。間苯二酚法測定PSP中果糖含量為93.81%。PSP的剩余單糖組成如圖1C所示,包含葡萄糖(5.12%)、甘露糖(0.15%)、半乳糖(0.5%)、阿拉伯糖(0.21%)和半乳糖醛酸(0.21%)。這些數(shù)據(jù)表明PSP是一種以果糖為主要單糖的雜多糖。

2 )PSP的FT-IR光譜分析
從圖1D PSP的FT-IR光譜可以看出,3387.41 cm1處的強烈吸收峰主要是O - H的拉伸振動引起的,2935.02 cm-1處是C - H的吸收峰,兩者都是多糖的特征吸收峰。在1638.44 cm-1、1417.04 cm-1、1129.94 cm-1和1029.16 cm-1處的吸收峰分別歸屬于C=O、COOH、C * * * OH、C * * * * * * C的拉伸振動,提示糖醛酸和吡喃環(huán)的存在(圖1D)。878.19 cm-1處的吸收峰歸屬于α型糖苷鍵。此外,933.09 cm-1和818.12 cm-1處的吸收峰歸屬于具有β型糖苷鍵的呋喃糖環(huán)(圖1D)。
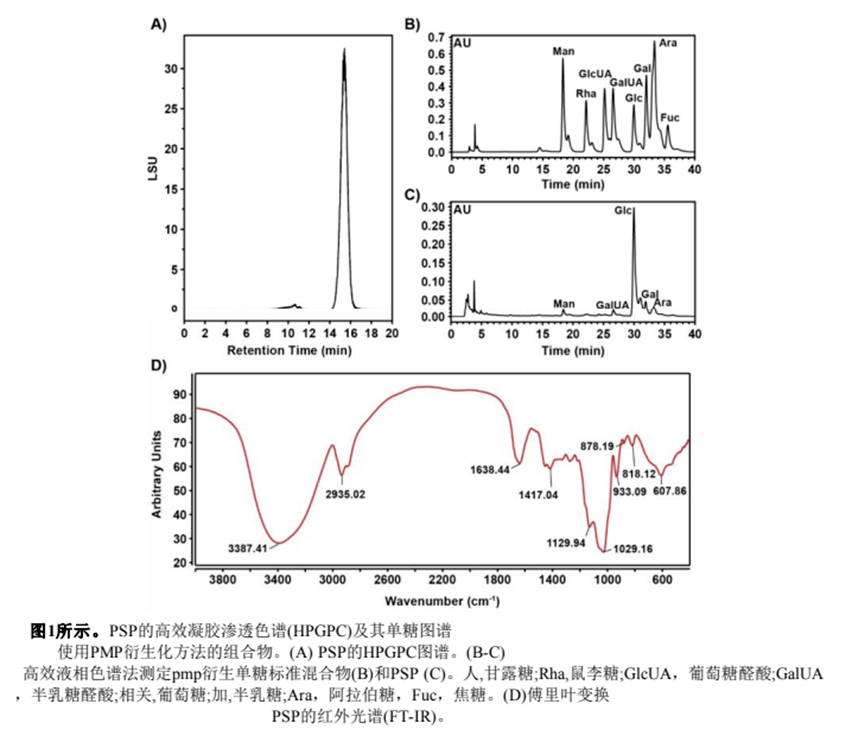
3) 甲基化法測定PSP糖渣
為了確定PSP中糖苷鍵的類型,我們用GC-MS對PSP的部分甲基化糖醇乙酸酯(PMAAs)進行了甲基化分析。結(jié)果表明,PSP衍生物含有兩個PMAAs(補充圖1A)。PSP總離子色譜(TIC)的峰1被鑒定為Terminal-D-glucopyranosyl(補充圖1B和補充表1)。甲基化分析中果糖的糖苷鍵類型尚不清楚,將結(jié)合NMR分析推斷。
4 )PSP的核磁共振(NMR)分析
利用一維和二維NMR譜分析了PSP的結(jié)構(gòu)。PSP的1H NMR譜如圖2A所示。由于酮糖沒有端粒質(zhì)子,因此在端粒質(zhì)子區(qū)只出現(xiàn)δ 5.43 ppm的單一信號,該信號被分配給α- d -葡萄糖醛酸殘基的H-1。大部分質(zhì)子信號集中在δ 3.4±4.4 ppm。結(jié)果表明,PSP中既有α-構(gòu)型(δ > 5.0 ppm),也有β構(gòu)型(δ < 5.0 ppm),且以β-構(gòu)型為主Z.H. Qi et al. / Food Science and Human Wellness 13 (2024)FT-IR分析(圖1D)。在13C NMR譜(圖2B)中,大多數(shù)碳信號來自δ 60±110 ppm區(qū)域。在δ 103.6 ppm的端粒碳區(qū)觀察到的信號被分配到果糖殘留物的典型峰(C-2)。根據(jù)1H1H COSY和HSQC光譜(圖2C和2D)對果糖殘基的氫信號進行分配。13C NMR譜(圖2B)中δ 60.43 ppm、δ 76.72 ppm、δ74.33 ppm、δ 81.06 ppm和δ 62.24 ppm的碳信號分別對應果糖殘基的C-1、C-3、C-4、C-5和C-6。此外,葡萄糖殘基的碳信號較弱,在13C NMR譜中未被識別,這與PSP中葡萄糖含量較低一致(表1)。最后,糖殘基的1H和13C化學位移信號總結(jié)如表2所示。
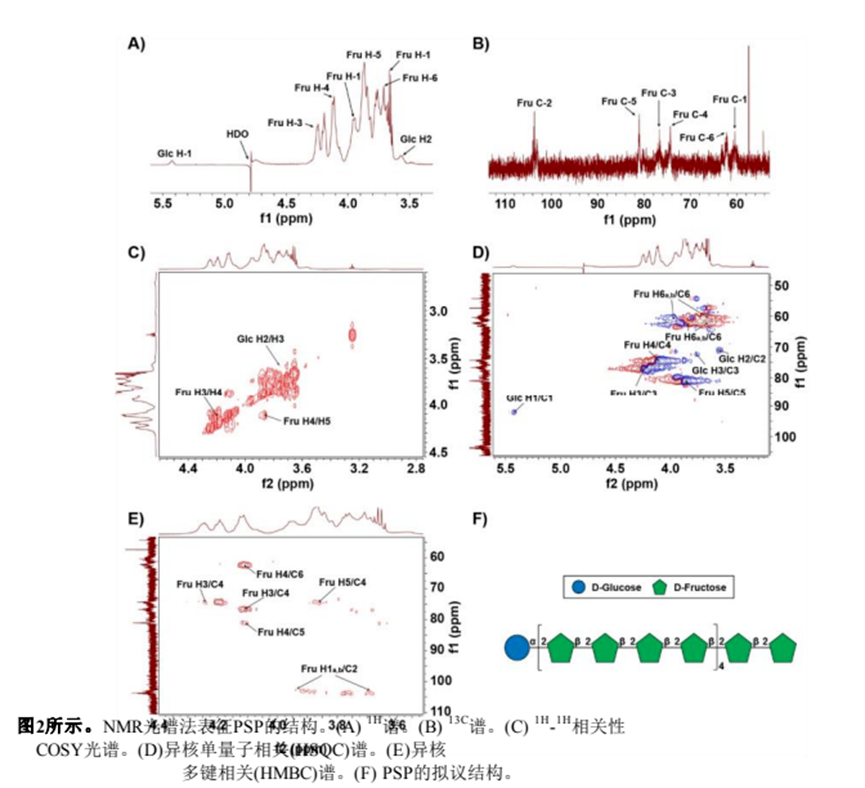
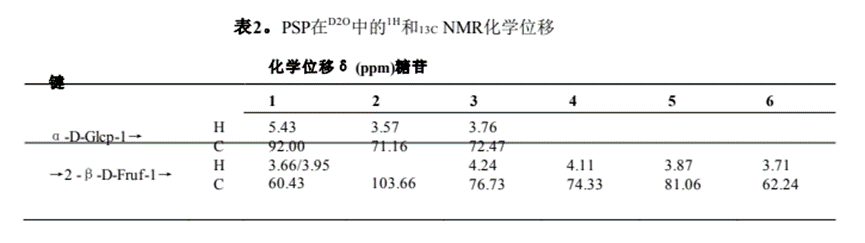
通過HMBC光譜中的相關(guān)峰確定PSP中糖殘基的序列和連鎖位點(圖2E)。果糖殘基氫信號H-1 (δ 3.66, 3.95 ppm)和碳信號C-2 (δ 103.66 ppm)有相關(guān)的信號峰,表明PSP中存在→2)-β- d - fruf -(1→2)-β- d - fruf -(1→2)鏈。通過甲基化分析和已報道的葡萄糖殘基NMR譜[25,26],我們推測葡萄糖殘基的鍵合形式為α-D-Glcp-(1→2)-β- d - fruf -(1→)。綜合分析單糖組成、FT-IR和NMR信息分析,我們提出了PSP的預測結(jié)構(gòu),如圖2F和補充圖2所示。
5) 模擬PSP體外消化
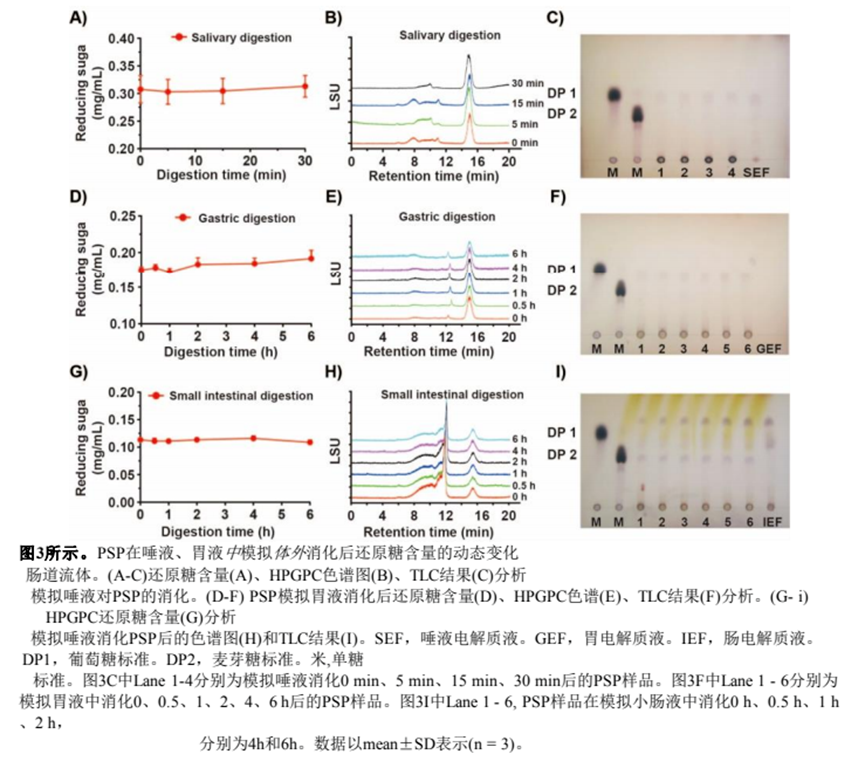
口腔作為食物攝入后的第一個消化部位,分泌α-淀粉酶,催化α-1,4糖苷鍵的水解[27]。為了觀察唾液是否能夠分解PSP,我們將PSP與模擬唾液溶液孵育0- 30min。如圖3A所示,整個消化過程中,消化液中的還原糖含量保持在0.31 mg/mL。同時,不同時間消化后PSP的HPGPC譜沒有變化(圖3B)。TLC結(jié)果也是如此,表明唾液消化PSP沒有產(chǎn)生新的產(chǎn)物(圖3C)。總之,我們認為唾液不能消化PSP,這意味著PSP中的糖苷鍵不能被α-淀粉酶水解。在口腔中初始消化后,食物會通過食道轉(zhuǎn)運到胃中進行后續(xù)消化。因此,我們將唾液消化的PSP溶液與模擬胃液孵育。如圖3D-F所示,在整個消化過程中,PSP的還原糖含量、HPGPC圖譜和TLC結(jié)果沒有發(fā)生變化。綜上所述,PSP在酸性條件下(pH 3.0)的胃液中沒有被分解。小腸是營養(yǎng)物質(zhì)消化和吸收的主要部位,因此我們研究了小腸液是否可以分解PSP。如圖3G和3H所示,胃液消化PSP溶液與模擬小腸消化液孵育不同時間后,PSP的還原糖含量和HPGPC色譜均未見明顯變化。值得注意的是,TLC結(jié)果顯示,小腸液消化PSP后產(chǎn)生少量單糖。
6) PSP的體外發(fā)酵
考慮到腸道菌群可以通過糖苷水解酶代謝飼糧中的多糖[3,19],我們下一步研究了人類腸道菌群對PSP的發(fā)酵。
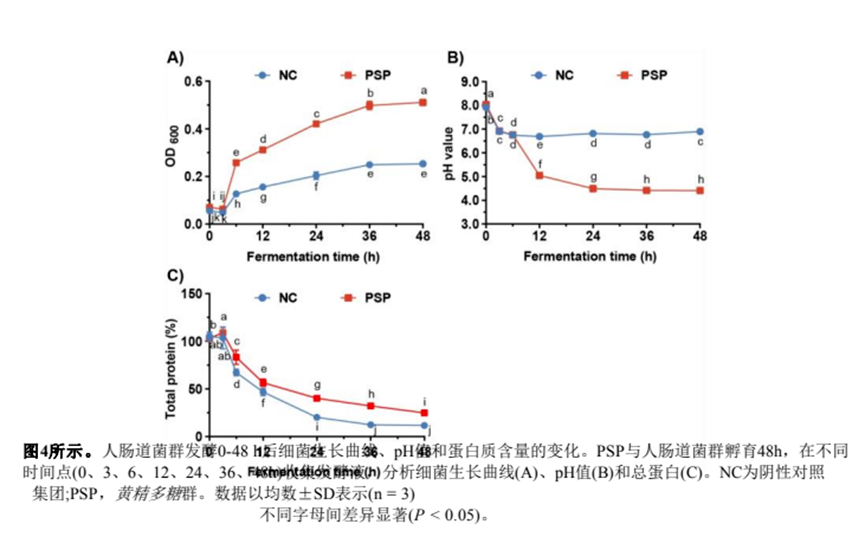
(6.1) PSP發(fā)酵液細菌生長曲線、pH值及蛋白質(zhì)含量分析
我們首先檢測了發(fā)酵液中腸道菌群的生長曲線。如圖4A所示,陰性對照(NC)組的吸光度值(OD600)在3 h時迅速上升,然后在36 h時達到生長平臺,吸光度值增加到0.25。與NC組相比,PSP組的OD600在36 h達到0.49,在48 h繼續(xù)上升到0.51(圖4A)。發(fā)酵6 h后,PSP組發(fā)酵液的OD600始終高于NC組。
細菌在代謝多糖時會產(chǎn)生酸性代謝物(如SCFAs和乳酸),導致腸道pH值降低,腸道菌群結(jié)構(gòu)改變。結(jié)果如圖4B所示表明,NC組發(fā)酵6 h后pH值降至6.7,并在后續(xù)發(fā)酵過程中保持穩(wěn)定。相比之下,PSP組在發(fā)酵過程中pH值顯著降低,在48 h時降至4.4(圖4)。
此外,我們檢測了發(fā)酵液中的總蛋白含量,在NC或PSP組的發(fā)酵過程中,總蛋白含量呈下降趨勢(圖4)。發(fā)酵48 h后,PSP組蛋白質(zhì)含量為24.9%,NC組蛋白質(zhì)含量為11.7%。
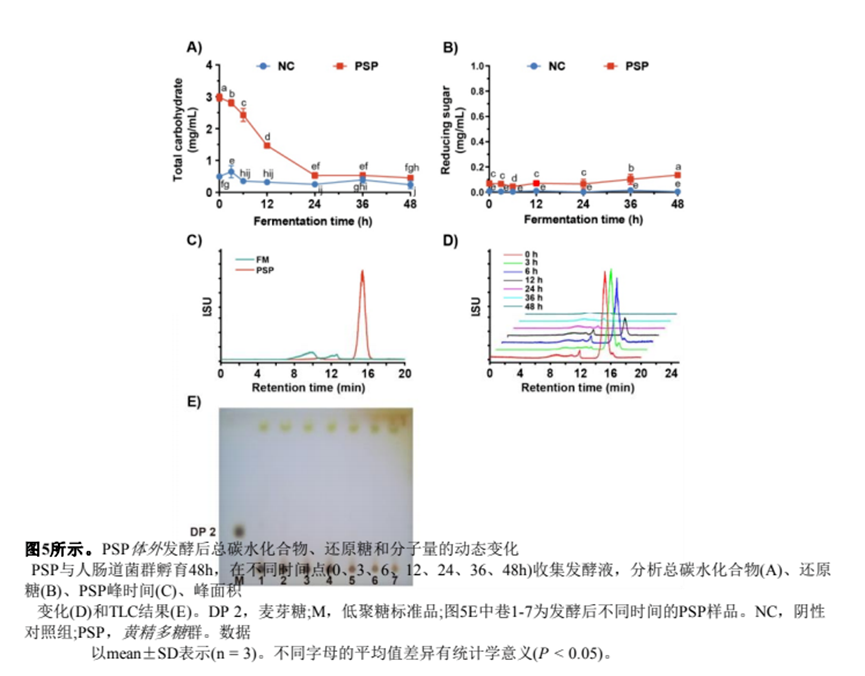
(6.2) 總碳水化合物、還原糖和分子量的動態(tài)變化
進一步,我們測試了發(fā)酵液中總碳水化合物的動態(tài)變化。對于PSP組,發(fā)酵324 h后總碳水化合物迅速下降,最終在48 h時降至0.45 mg/mL(圖5A)。同時,發(fā)酵過程中總碳水化合物的84.9%被腸道菌群利用。
由于來自腸道菌群的糖苷酶可以破壞多糖的糖苷鍵,從而增加還原糖的產(chǎn)生[29],我們比較了兩個實驗組發(fā)酵液中還原糖含量的差異。如圖5B所示,在整個發(fā)酵過程中,NC組的糖含量沒有明顯變化。相比之下,PSP組的還原糖含量在48 h時增加到0.14 mg/mL(圖5)。
由于發(fā)酵液的復雜性,NC組的峰值出現(xiàn)在812 min,而PSP的峰值出現(xiàn)在15.3 min(圖5C)。同時,我們用HPGPC分析了發(fā)酵液中不同時間點的PSP(圖5D)。結(jié)果表明,PSP峰面積隨濃度的增加而逐漸減小發(fā)酵時間。發(fā)酵24 h后,HPGPC譜顯示PSP的殘留量極低,表明PSP被腸道菌群分解。此外,TLC結(jié)果證實發(fā)酵液中總碳水化合物在發(fā)酵過程中明顯減少(圖5)。
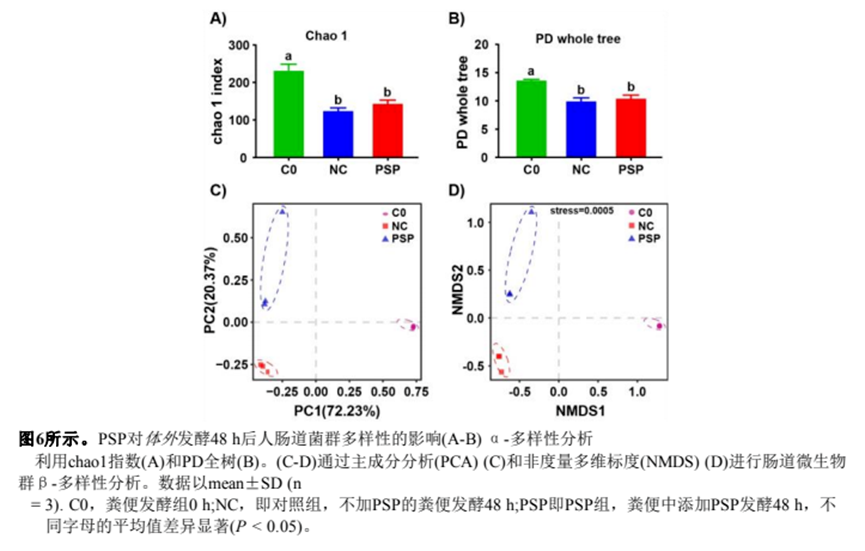
7 )PSP對腸道菌群組成的影響
為了評估PSP的益生元潛力,我們通過16S rDNA測序評估了PSP對體外腸道微生物群的影響。利用Chao 1和PD全樹指數(shù)進行α-多樣性分析,PSP增強了腸道微生物群落的多樣性(圖6)。通過主成分分析(PCA)和非度量多維標度(NMDS)的β-多樣性評估,將腸道菌群樣本劃分為三個不同的分類群,表明實驗組之間腸道菌群分化良好(圖6)。
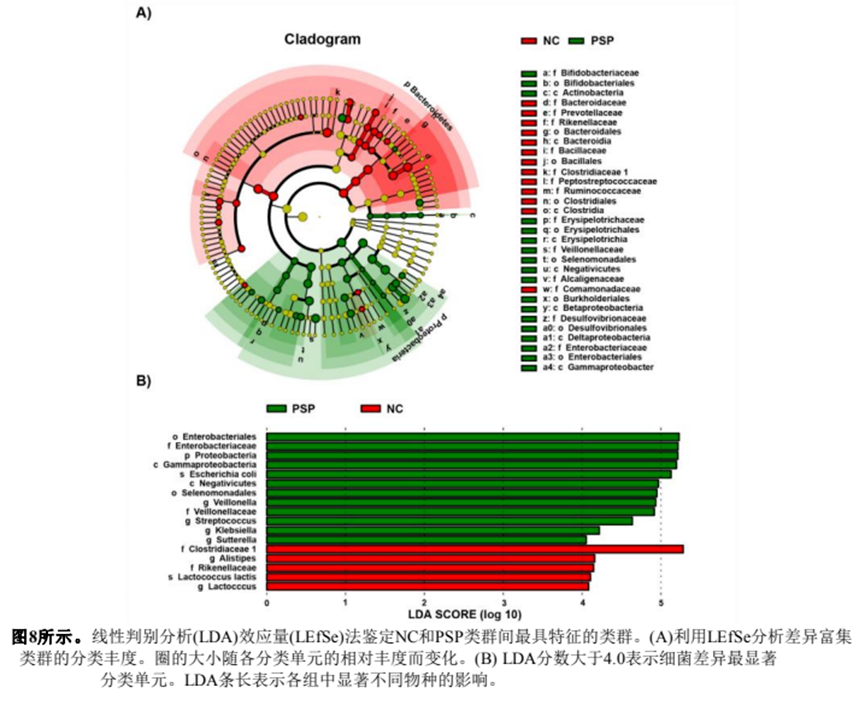
為了研究PSP對特定腸道菌群的調(diào)節(jié)作用,我們分析了各組腸道菌群的相對豐度變化。在門水平上,各組腸道菌群主要由厚壁菌門(Firmicutes)、擬桿菌門(Bacteroidetes)和變形菌門(Proteobacteria)組成,約占細菌群落總數(shù)的95%(圖7A)。與NC組相比,PSP顯著提高了變形菌門和放線菌門的比例(P < 0.05)(圖7A)。在科水平上,PSP增加了Veillonellaceae、Enterobacteriaceae和Alcaligenaceae的豐度(P < 0.05,與NC組相比)。相比之下,PSP降低了Bacteroidaceae和Clostridiaceae的含量(P < 0.05,與NC組相比)(圖7)。
接下來,我們在屬水平上比較了NC組和PSP組腸道菌群的相對豐度差異。如圖7C所示,通過分層聚類熱圖分析了23個最易變的細菌屬。與NC組相比,PSP組增加了部分細菌的豐度(如蘇特菌和雙歧桿菌),減少了部分細菌的豐度(如擬桿菌和擬桿菌)(P < 0.05)。發(fā)酵48 h后,NC組的核心微生物為擬桿菌(Bacteroides)(29.7%)、擬桿菌(A listipes)(3.15%)和乳球菌(Lactococcus)(3.09%)(補充圖3)。PSP組以擬桿菌(Bacteroides)(17.2%)、微孔菌(Veillonella)(6.98%)、克雷伯菌(Klebsiella)(2.35%)和蘇特菌(Sutterella)(3.21%)為主(補充圖3)。

采用線性判別分析效應量(LEfSe)方法對各試驗組的特定細菌分類群進行分析。如圖8A所示,PSP中的主要細菌是Proteobacteria分支,NC組中的特征細菌是Bacteroidetes,在碳水化合物的發(fā)酵中起著至關(guān)重要的作用。繪制LDA評分(log 10)直方圖,分析兩組優(yōu)勢菌。如圖8B所示,對照組的優(yōu)勢菌為f_Clostridiaceae 1、g_Alistipes、f_Rikenellaceae和g_Lactococcus。PSP組優(yōu)勢菌群為o_Enterobacteriales、p_Proteobacteria、c_Gammaproteobacteria等13種。
8) PSP對短鏈脂肪酸和吲哚生成的影響
由于短鏈脂肪酸和吲哚是攝入多糖后的主要細菌代謝物,我們在發(fā)酵48 h后檢測了NC組和PSP組之間這兩種代謝物的含量。如圖9A所示,在發(fā)酵過程中,兩組的總短鏈脂肪酸水平均有所升高。PSP組總短鏈脂肪酸濃度由0 h時的(3.32±0.14)μg/mL升高至48 h時的(98.21±5.51)μg/mL,顯著高于NC組(P < 0.01)。結(jié)果表明,PSP促進了腸道菌群中短鏈脂肪酸的產(chǎn)生。
其中,36 h時,NC組乙酸濃度為(12.24±0.58)μg/mL, PSP組為(56.22±4.53)μg/mL(圖9B)。發(fā)酵3 ~ 48 h期間,PSP組乙酸水平顯著高于NC組(P < 0.01)(圖9B)。PSP組丙酸濃度在36 h達到(34.36±4.92)μg/mL(圖9C)。與上述兩種短鏈脂肪酸不同,丁酸和戊酸主要在腸道菌群發(fā)酵后期產(chǎn)生(圖9D和9E)。發(fā)酵48 h后,測定PSP組丁酸和戊酸含量分別為(23.82±0.67)μg/mL和(3.58±0.35)μg/mL。顯著高于NC組(圖9D和9E)。此外,我們通過GC-MS檢測吲哚的含量。結(jié)果表明,NC組與PSP組在發(fā)酵初期(0 ~ 6 h)吲哚濃度無顯著差異,但從發(fā)酵12 h開始,NC組的吲哚濃度高于PSP組(P < 0.01)(圖9)。

9) PSP發(fā)酵液的抗氧化活性
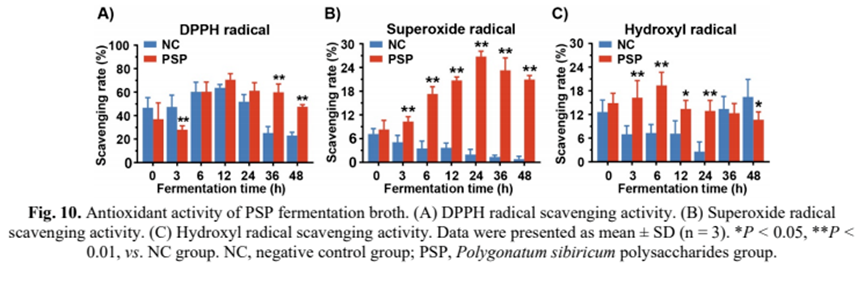
最后,我們考察了PSP發(fā)酵液對自由基的清除作用。與NC組相比,PSP發(fā)酵增強了腸道菌群對DPPH自由基的清除率(圖10A),在12 h時清除率最高可達70.59%。另一方面,PSP組的超氧自由基清除率逐漸提高,在24 h時達到峰值(26.76%)(圖10b)。總體而言,PSP組對超氧自由基的清除能力明顯高于PSP組。有趣的是,在發(fā)酵過程中,NC對超氧自由基的清除能力呈下降趨勢(圖10B)。此外,PSP組對羥基自由基的清除效果比NC組要好(圖10)。
3 結(jié)論
從黃精中分離得到分子量為3.06 kDa的果聚糖多糖。通過模擬消化和體外發(fā)酵的人體腸道菌群,我們證明了唾液、胃液和小腸消化液不能分解PSP。相比之下,腸道細菌顯示出較高的PSP代謝活性。在PSP發(fā)酵過程中,腸道菌群的多樣性和豐度受到顯著影響,同時大量產(chǎn)生乙酸、丙酸、丁酸和戊酸等短鏈脂肪酸。此外,PSP發(fā)酵液還具有清除自由基的作用。我們的研究揭示了將PSP作為一種潛在的益生元應用于食品和制藥工業(yè)。
上文引用:Food Science and Human Wellness
ISSN 2097-0765e-ISSN 2213-4530 CN 10-1750/TS
Editor-in-Chief: Bin Cong
https://www.sciopen.com/article/10.26599/FSHW.2022.9250184
版權(quán):© 2024 北京食品科學研究院.